Des chercheurs de l’UMONS révèlent une mémoire mécanique du cytosquelette cellulaire : une découverte publiée dans Nature Physics
La migration cellulaire joue un rôle clé dans des processus aussi variés que le développement embryonnaire, la régénération des tissus ou la progression des cancers. Comprendre comment les cellules se déplacent et s’adaptent à leur environnement représente donc un enjeu majeur en biologie et en médecine.
« Si les signaux biochimiques ont longtemps été au cœur des recherches, l’attention des scientifiques se porte désormais sur les forces mécaniques, internes et externes, qui influencent profondément la dynamique cellulaire », souligne Sylvain Gabriele, un des auteurs de l’étude et Président de l’Institut de recherche Biosciences de l’UMONS.
Dans le cas du cancer, les métastases apparaissent lorsque des cellules quittent la tumeur primaire pour migrer vers d’autres organes, en traversant des espaces plus petits que leur propre taille. Des études récentes montrent que, lorsqu’elles migrent dans un espace confiné, ces cellules subissent des cycles répétés de déformation et de relaxation.
Pour progresser dans cet environnement complexe, les cellules doivent continuellement adapter leur forme. Mais une question essentielle demeurait : une cellule peut-elle garder en mémoire ses états mécaniques passés pour mieux s’adapter aux contraintes futures ?
Des preuves d’une mémoire mécanique cellulaire
En combinant des microsystèmes innovants et de la microscopie de pointe, l’équipe du Prof. Sylvain Gabriele a étudié les transitions de forme cellulaire successives lors de la migration de cellules épithéliales mammaires dans des microenvironnements confiés.
Leurs résultats expérimentaux, couplés à une approche théorique en collaboration avec l’équipe du Prof David Brûckner de l’Université de Basel (Suisse), a permis de montrer que les cellules épithéliales – qui tapissent les surfaces et cavités du corps – initialement allongée adoptaient une forme fortement compactée qui lui permettait de migrer plus rapidement et avec une meilleur efficacité dans des passages fortement étroits.
Les chercheurs de l’UMONS ont découvert que le cortex d’actine, une fine couche de filaments située juste sous la membrane cellulaire, joue un rôle central dans ce processus. Lorsqu’une cellule adopte une forme très compacte dans un environnement confiné, ce cortex agit comme un véritable réservoir de tensions mécaniques, qui influence la dynamique de la cellule bien après que sa forme ait changé. En d’autres termes, la cellule garde en mémoire ses contraintes passées et peut maintenir cette forme compactée.
Ce concept de mémoire mécanique cellulaire apporte un éclairage nouveau sur la plasticité des cellules et leur capacité d’adaptation. Il pourrait notamment contribuer à mieux comprendre comment des cellules cancéreuses s’adaptent à des environnements variés pour former des métastases, ou comment guider des cellules souches dans des thérapies de régénération tissulaire.
Ces travaux démontrent une fois encore l’importance des approches interdisciplinaires, à la croisée de la biologie cellulaire, de la physico-chimie des surfaces et de la mécanique, pour décrypter les mécanismes complexes du vivant.
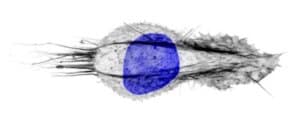 |
Image de microscopie confocale à haute résolution d’un cellules épithéliale en morphologie compactée avec les filaments d’actine en gris et l’ADN du noyau en bleu. Le train migre de la gauche vers la droite.
Source
The actin cortex acts as a mechanical memory of morphology in confined migrating cells.
Yohalie Kalukula, Marine Luciano, Gleb Simanov, Guillaume Charras, David B. Brückner & Sylvain Gabriele*
Nature Physics (2025) – DOI : 10.1038/s41567-025-02980-z.



